以加速剂为基础的硼中子俘获(BNCT)治疗恶性胶质瘤
人类胶质母细胞瘤是极为常见的胶质瘤,是极为恶性和耐辐射的肿瘤之一。胶质母细胞瘤的标准治疗方法是手术切除与辅助放疗和化疗相结合。然而,尽管现代疗法和复杂的、多学科的治疗取得了进步,诊断后的平均总生存率仅为15个月。

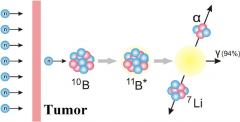
硼中子俘获疗法(BNCT)是治疗脑肿瘤的一个有前途的方向。罗赫尔在1936年首次提出了双星理论,该理论是基于两种相对无害的组分的相互作用而设计的:一个10b的原子核和一个热中子。10B在肿瘤细胞内的选择性积累和随后超热中子的照射只会破坏肿瘤细胞。与此同时,周围的健康细胞不会受到辐射的损害,这主要是由于硼的积累较少。在核反应堆进行的临床试验显示,BNCT在治疗脑瘤,包括胶质母细胞瘤,以及软组织肿瘤、实质器官肿瘤和皮肤癌方面的疗效。
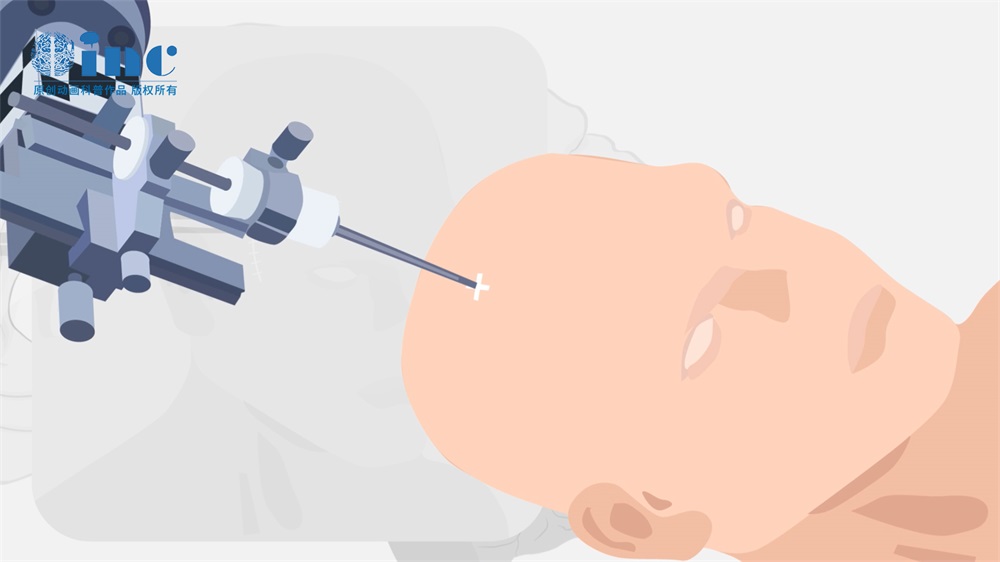
BNCT需要能量范围窄、通量密度高的中子,直到最近,唯一满足这些要求参数的中子源是专门的或改造的核反应堆。然而,可用于进行BNCT的加速器的建设始于20世纪90年代,到目前为止,已经在不同国家建立了几个专用装置的原型。使用加速器进行BNCT的优点是辐照束中超热中子含量高,可以在辐射的负面影响更小的情况下达到更大的治疗效果。目前较为先进的BNCT装置之一位于新西伯利亚科学城的Budker核物理研究所,它基于真空绝缘和锂靶的串联加速器。由于其独特的结构,该设施获得了能量为2 MeV、电流高达5 mA的固定质子束,足以实现体外和体内BNCT的成功结果。成功的BNCT需要富含10B同位素的化合物,需要在肿瘤组织中积累浓度大于20 g / g,在照射过程中浓度比为3:1(肿瘤与正常组织)或更高。目前,在临床试验中应用广泛的10B化合物是硼癸酸钠(BSH)和硼苯丙氨酸(BPA)。然而,大量研究表明,这些药物没有足够的选择性,世界范围内正在以两种方式开展开发能够在肿瘤组织中选择性积累的新10B化合物的研究。一方面,具有适宜BNCT特性的含硼药物的开发正在进行,另一方面,针对可通过血脑屏障(BBB)的含硼化合物的靶向给药技术正在开发中。
在所有受辐照动物组中,与未辐照至辐照后29天的未接受辐照的对照组相比,肿瘤大小减小且肿瘤生长减慢。在未经照射的未治疗动物中观察到极大的肿瘤生长,其中所有动物中的肿瘤均超过3cm 3的体积,因此该组在照射后第30天从实验中退出。与未治疗的对照组相比,在辐射后观察的第一个月中,治疗组的肿瘤体积平均增加约低3倍,而在辐射后第二个月,在所有治疗组中观察到更明显的肿瘤生长。
一般而言,当前研究中观察到的肿瘤生长抑制作用与先前的体外研究结果一致(在Budker核物理研究所的同一加速器上进行),该研究表明BNCT对U251的生长具有显着的抑制作用。神经胶质瘤细胞,T98-G,CHO-1K和V-79肿瘤细胞与BPA孵育。在许多方面,这类似于BNCT后Nu / J小鼠皮下植入的U87肿瘤生长的体内研究。
在Kanygin等人的先前研究中,在中子辐照前1.5小时,在装有皮下U87人神经胶质瘤的Nu / J小鼠的眶后窦注射100 mg / kg的BSH。这导致了BNCT的可证明的治疗效果,因为与未治疗的对照组(从照射后第4天开始观察)相比,治疗组出现了显着的肿瘤生长抑制,而BSH治疗组的存活率提高了30%。
我们发现:在免疫缺陷动物中,我们观察到以加速器为基础的中子源的BNCT有降低或延缓人胶质母细胞瘤生长的趋势。与双酚a和非脂质体BSH相比,脂质体BSH表现出更好的长期效果,尽管只是在2个月的随访期结束时。为了改善治疗效果,目前正在研究脂质体硼给药的进一步改进。体内研究也证明了中子束的安全性。因此,专门为BNCT设计的以加速器为基础的中子源,具有创造相当均匀地产生加速超热中子的独特能力,无疑将为更广泛的研究提供机会,但仍需要更多时间和临床实践。
参考文献:DOI:10.1080/09553002.2020.1761039




 INC国际神经外科集团
INC国际神经外科集团 关注微信公众号
关注微信公众号